اسیدها و بازها در همه جا و همه مواد وجود دارند. تقریبا مواد بسیار کمی وجود دارد که عضو هیچ یک از این دو گروه نباشند و در واقع خنثی باشند. گاهی اوقات تشخیص این دو از هم دشوار است و ما در مورد اسیدی یا بازی بو دن مواد به مشکل برمیخوریم با ما همراه باشید تا در مورد هر دو گروه صحبتهایی داشته باشیم.
اسید و باز شکلی از مواد شیمیایی هستند که نقش حیاتی در شیمی دارند و به راحتی در زندگی روزمره ما در دسترس میباشند. اسید سیتریک، اسید فسفریک، اسید استئاریک و … نمونههایی از اسیدها هستند و آنیون هیدرید، آنیون آمید-آزانید، آنیون هیدروکسید نیز نمونه هایی از بازها میباشند که هر گروه به نوبه خود در مواردی مورد استفاده قرار میگیرند.
اسید ها
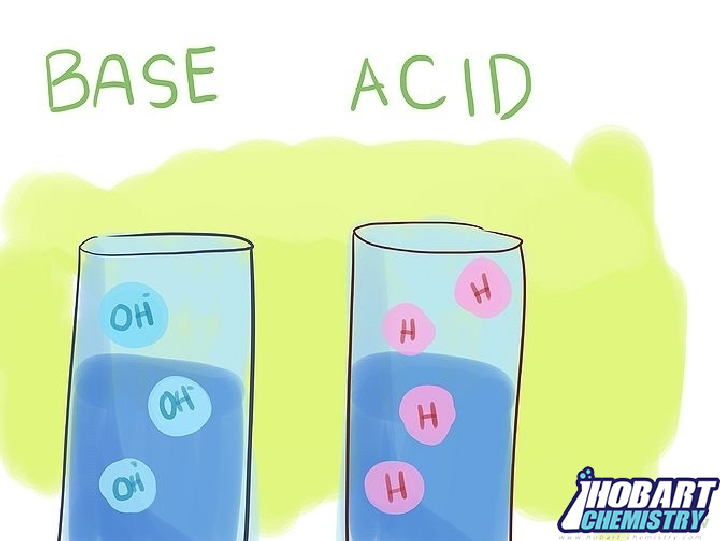
به مادهای که در واکنش با ماده دیگر الکترون بپذیرد، اسید گفته میشود. لایه بیرونی اسیدها پس از پذیرش جفت الکترون در لایه ظرفیتی آنها کامل میگردد. لازم به ذکر است که هیچ تغییری در حالت اکسیداسیون واکنش از جمله اسیدها وجود ندارد. به تعریف دیگر اگر ماده ای در حال اهدای پروتون (اهداکننده یون هیدروژن) باشد، به آن ماده اسید گفته میشود.
H + (aq) + OH – (aq) H 2 O (l)
باز ها
باز به گونهای از مواد شیمیایی گفته میشود که الکترون میدهد و پروتون میپذیرد. یا یونهای هیدروکسید (OH-) را در محلولهای آبی آزاد میکند. در صورتی که ماده موجود در محلول آبی دارای مقدار pH بالاتر از 7.0 است. به آن ماده خاصیت بازی میدهد. بازها دقیقاً متضاد شیمیایی اسیدها هستند. در ساختار آنها موادی میباشند که در یک محلول آبی، یونهای هیدروکسید آزاد میکنند.
مواد خنثی
وقتی یک اسید و یک باز (به مقدار مناسب) با هم مخلوط شوند، یکدیگر را خنثی میکنند. این بدان معنی است که آنها با هم به چیزی تبدیل میشوند که نه اسید است و نه باز، بنابراین هر دو گروه خاصیت خود را از دست داده. و ماده جدیدی که از این دو ماده تشکیل میشود یک ماده خنثی خواهد بود.
برخی از مواد خنثی زمانی تشکیل میشوند که یک اسید با یک باز مخلوط میشود بنابراین یک واکنش خنثی سازی رخ میدهد بعضی موادها به خودی خود خنثی بوده و حاصل ترکیب باز و اسیدها نمیباشند این مواد خنثی که جزو شناخته شده ترین مواد هستند عبارتند از: آب، نمک خوراکی، محلول شکر و روغن پخت و پز.
pH چیست؟
pH یعنی اندازه گیری اسیدی یا بازی بودن هر ماده، محدوده pHدر حدود 0 تا 14 است که 7 مقدار خنثی میباشد. اسیدیته با pH کمتر از 7 نشان داده میشود، در حالی که pH بیشتر از 7 نشان دهنده باز بودن ماده است. pH در واقع اندازه گیری نسبت یون های هیدروژن و هیدروکسیل آزاد در ماده می باشد.
تفاوت اسید ها و باز ها
اسیدها به طور کلی در فرم مایع موجود هستند. که در واکنشها یک پروتون اهدا میکند یا یک جفت الکترون میپذیرند. بعلاوه اسیدها غلظت یونهای H+ را نیز افزایش میدهند.
در مقایسه اسید و باز میتوان گفت که باز ها مادهای هستند که یونهای هیدروکسید (OH-) را در محلول آبی آزاد میکنند، الکترون اهدا کرده وپروتون میپذیرند. به طور مشخص اسید و باز کاملا برعکس هم عمل میکنند.
اسیدها دارای pH کمتر از 7 هستند ودر بازها پایهها دارای مقدار pH7 میباشند. باز یک پایه رنگ صورتی به مادهای که با آن مخلوط شده میدهد اما اسید توانایی رنگدهی نداشته و بیرنگ میماند.
در آزمایشگا ها برای تشخیص اسیدی یا بازی بودن ماده ای از کاغذی به نام کاغذ تورنسل استفاده می شود این کاغذ ها در بر خورد با ماده اسیدی رنگ کاغذ آبی را، به رنگ قرمز تبدیل می کند و در مقابل ماده بازی کاغذ تورنسل آبی را به رنگ قرمز تبدیل میکند.
از لحاظ فرمول شیمیایی فرمول اسیدها با H شروع میشود. به عنوان مثال، هیدروکلریک اسید(HCl). ولی فرمول شیمیایی در مورد بازها به OH ختم میشود. به عنوان مثال، سدیم هیدروکسید (NaOH)یک باز میباشد..
هر اسیدی بستگی به غلظت یونی، دارای هیدرونیوم است. (هنگامی که یک اسید آرنیوس در آب حل شده باشد، هیدورنیوم به عنوان یک یون با بار مثبت حضور خواهد داشت.) به عنوان مثال رزین سختی گیر از نوع رزین کاتیونی اسیدی قوی که در فرایند تبادل یون در سیکلهای سدیمی و یا هیدروژنی مورد استفاده قرار میگیرند. رزین ها در تصفیه آب بسیار عالی عمل میکنند نحوه تاثیر اسیدها بدین گونه است که هنگام مخلوط شدن با آب تجزیه شده و یون هیدروژن آزاد میکنند به این ترتیب استفاده از رزین کاتیونی در تصفیه آب بسیار موثر واقع میشود.
در خصوص بازها باید گفت که این ویژگی بستگی به غلظت یونها دارای هیدروکسید میباشد هنگامی که با آب مخلوط میگردند، تجزیه شده تا یونهای هیدروکسید آزاد کنند.
لازم به ذکر است از اسیدها به عنوان تمیز کننده خانگی، در نوشیدنیهای گازدار، پردازش چرم، و در نگهدارندهها و کودها استفاده میشود. و از بازها در ساخت صابون، رفع سختی آب، برای پاک کردن لکههای چربی از روی لباسها، به عنوان جوش شیرین در شیرینیپزی و… استفاده میگردد.
تفاوت در یونیزاسیون
اسیدها گونهها یا ترکیباتی هستند که در H2O از هم جدا شده و یک یون هیدروژن (H+) تشکیل میدهند. بنابراین میتوان گفت که اسیدها در یونیزاسیون یونهای هیدرونیوم را تشکیل میدهد. بازها در یونیزاسیون یونهای هیدروکسیل ایجاد میکنند.
تفاوت در فرمول شیمیایی
اسیدها
فرمول شیمیایی اکثر اسیدها با H شروع میشود. به عنوان مثال، اسید نیتریک (HNO 3 )، اسید کربنیک در نوشابه ها (H 2 CO 3 )، اسید بوریک (H 3 BO 3 )، اسید کلریدریک (HCl)، اسید اگزالیک ( H2C2O4 )و اسید سولفوریک ( H2SO4 ) . با این حال، استثناهایی مانند اسید استیک (CH 3 COOH) وجود دارد.
بازها
فرمول شیمیایی اکثر بازها (ترکیبات) در انتها دارای OH است. به عنوان مثال، هیدروکسید کلسیم یا آهک خرد شده، Ca (OH) 2(کاغذ، لخته ساز)، هیدروکسید منیزیم (Mg (OH) 2 ) یا شیر منیزیم، هیدروکسید سدیم (NaOH) یا سود سوزآور (ماده تمیز کننده، تنظیم کننده PHهیدروکسید آمونیوم (NH 4 OH) یا آب آمونیاک (KOH ) هیدروکسید پتاسیم هستند.
تفاوت در کاربردها
اسیدها
از این ماده برای ساخت پاک کنندهها که برای نظافت منزل مورد استفاده قرار میگیرد، استفاده میشود. بعلاوه آن را جهت مصارف صنعتی نیز مورد استفاده قرار میدهند. اسیدها، یعنی اسید سولفوریک و نیتریک، هر دو معمولاً در رنگ، کود و مواد منفجره استفاده می گردند.
به عنوان یک حل کننده فلز هیدروکلریک اسید (HCl) استفاده میشود که به حل شدن فلزاتی مانند پلاتین و طلا کمک میکند. همچنین از اسیدها سولفوریک برای ساخت باتری چراغ قوه و اتومبیل استفاده میشود. اسید سولفوریک نیز در فرآوری مواد معدنی مورد استفاده قرارمیگیرد. از این ماده برای جلوگیری از زنگ زدگی و خوردگی فلزات نیز استفاده میکنند.
در صنایع شیمیایی اسیدها به عنوان خنثی کننده در تولید نمک به کار میروند. به عنوان مثال، اسید نیتریک (HNO 3 ) با آمونیاک NH 3 برای تولید نیترات آمونیوم کاربرد دارند.
بازها
هیدروکسید سدیم (NaOH) در ساخت صابون، الیاف مصنوعی و کاغذ استفاده میشود. همچنین در ساخت برخی داروها و پالایش نفت، در تمیز کردن سینکها، اجاقها و فاضلابها استفاده میگردد. بی کربنات سدیم (NAHCO 3 ) که یک باز است در خمیر دندان، کپسول آتش نشانی و جوش شیرین موجود میباشد.
از هیدروکسید کلسیم (آهک خرد شده) در تولید پودر سفید کننده کاربرد دارد. این ماده با آب و ماسه مخلوط شده و ملات ایجاد میکند که در ساخت و ساز ساختمانها مورد استفاده قرار میگیرد. آهک آب شده نیز توسط کشاورزان در مزارع برای خنثی کردن اثرات خطرناک باران اسیدی به کار میرود. هیدروکسید کلسیم همچنین اسید موجود در منابع آب را خنثی کرده و همچنین به عنوان یک ماده پانسمان برای سوختگیهای ناشی از اسید، به عنوان پادزهر برای موارد مسمومیت غذایی، در ساخت قارچ کشها، در مخلوط سفید برای دندانپزشکی استفاده میگردد.