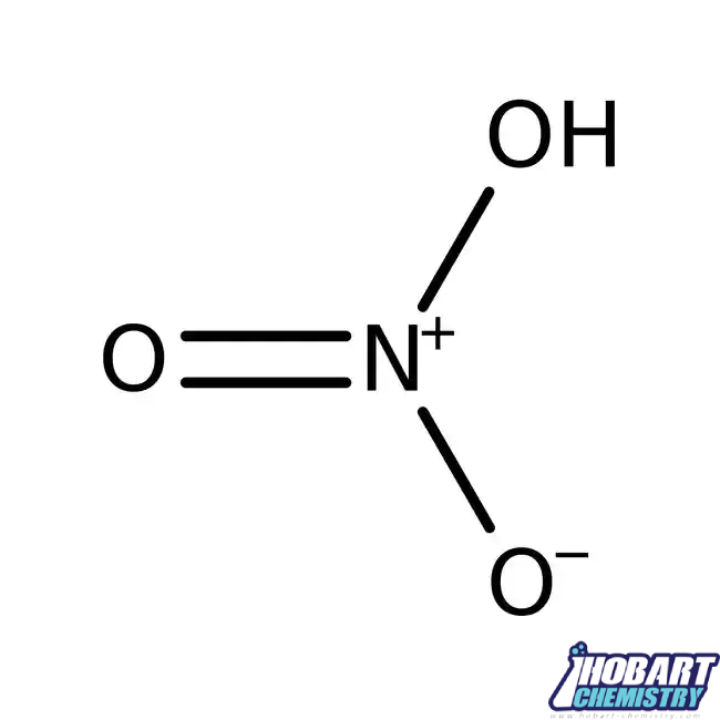
اسید نیتریک یک اسید معدنی بسیار قوی با فرمول شیمیایی می باشد که از عناصر هیدروژن، نیتروژن و اکسیژن تشکیل شده است و در طبیعت فقط به شکل نمک های نیترات وجود دارد. این اسید همچنین به نام های Soda saltpetre، شوره شیلی، Spirit of niter و Aqua fortis نیز شناخته می شود.
اسید نیتریک چیست؟
اسید نیتریک در شکل خالص خود بی رنگ است اما با افزایش سن به رنگ زرد تبدیل می شود. این رنگ به دلیل تجزیه این اسید قوی به اکسیدهای نیتروژن و آب ظاهر می شود. مایعی بی رنگ، دودزا، بسیار خورنده و سمی است. باعث سوختگی شدید پوست میشود. با هیدروکسیدها، فلزات و اکسیدها واکنش داده و نمکهای نیترات را تشکیل می دهد. اسید نیتریک را می توان با اکسیداسیون کاتالیزوری آمونیاک یا با تقطیر نیترات ها همراه اسید سولفوریک تولید کرد.
از این اسید معدنی به عنوان یک عامل اکسید کننده قوی استفاده می شود؛ به طور مثال در موشک های سوخت مایع، به عنوان اکسید کننده برای جلو راندن موشک مورد استفاده قرار می گیرد. همچنین یک معرف رایج مورد استفاده در آزمایشگاه ها و یک ماده شیمیایی مهم است که در صنایع برای تولید پلاستیک، رنگ، کود ها و مواد منفجره کاربرد دارد.
تاریخچه کشف اسید نیتریک
ماهیت شیمیایی و ترکیب اسید نیتریک اولین بار در سال ۱۷۸۴ توسط شیمیدان و فیزیکدان انگلیسی هنری کاوندیش (۱۷۳۱-۱۸۱۰) تعیین شد. کاوندیش یک جرقه الکتریکی را روی هوای مرطوب اعمال کرد و متوجه شد که یک ترکیب جدید تشکیل شده است. کاوندیش بعدها توانست خواص شیمیایی و فیزیکی اسید و ترکیب شیمیایی آن را تعیین کند.
روشی که امروزه بیشتر برای تهیه اسید نیتریک استفاده می شود، روشی است که در سال ۱۹۰۱توسط شیمیدان آلمانی روسی الاصل فردریش ویلهلم استوالد (۱۸۵۳-۱۹۳۲) ابداع شد. فرآیند استوالد، شامل اکسیداسیون آمونیاک بر روی کاتالیزور پلاتین یا مخلوط پلاتین رودیوم است.
امروزه اسید نیتریک یکی از مهم ترین ترکیبات شیمیایی مورد استفاده در صنعت است که رتبه سیزدهم را در بین تمام مواد شیمیایی تولید شده در ایالات متحده هر سال کسب می کند. در سال ۲۰۰۵، حدود ۶.۷ میلیون تن از این ترکیب در ایالات متحده تولید شد است.
کاربردهای اسید نیتریک
- در صنعت، برای ساخت ابریشم مصنوعی (ریون)، سلولوئید، عطر، دارو و رنگ کاربرد دارد.
- اسید نیتریک در تولید نیترات آمونیوم برای کود ها، ساخت پلاستیک و در ساخت رنگ استفاده می شود. همچنین برای ساخت مواد منفجره مانند نیتروگلیسیرین و TNT (ترینیتروتولوئن) استفاده می شود. هنگامی که با اسید هیدروکلریک ترکیب می شود، عنصری به نام Aqua regia تشکیل می دهد. این معرف قادر به حل کردن طلا و پلاتین است. علاوه بر این، در آزمایش رنگ سنجی برای تشخیص هروئین و مورفین کاربرد دارد.
- اسید نیتریک معمولاً در آزمایشگاه های علوم در مدارس در هنگام انجام آزمایشی خاص برای کلرید استفاده می شود. این کار با افزودن نمونه ای از محلول نیترات نقره به اسید نیتریک پایان می یابد که منجر به تولید رسوب سفید رنگ کلرید نقره و اثبات وجود کلرید در محلول می گردد. در زمینه پزشکی از اسید نیتریک در حالت خالص به عنوان ماده سوز آور برای از بین بردن شانکر و زگیل استفاده می شود. از محلول های رقیق شده آن نیز در درمان سوء هاضمه استفاده می شود.
- اسید نیتریک به اشکال مختلف به عنوان اکسید کننده در موشکهای سوخت مایع استفاده شده است. این اشکال شامل اسید نیتریک بخاردار قرمز، بخاردار سفید، مخلوط با اسید سولفوریک و اشکال با بازدارنده HF است.
- همچنین معمولاً در فرآیند هضم نمونه های آب کدر، نمونه های لجن جامد و همچنین انواع دیگر نمونه های منحصربهفرد که نیاز به تجزیه و تحلیل عنصری از طریق ICP-MS، ICP-OES، ICP-AES، GFAA و طیفسنجی جذب اتمی شعله دارند، کاربرد دارد.
- در سنتز آلی، اسید نیتریک ممکن است برای معرفی گروه نیترو استفاده شود. هنگامی که با اسید سولفوریک استفاده می شود، یون نیترونیوم تولید می کند که به صورت الکتروفیلی با ترکیبات معطر مانند بنزین واکنش می دهد.
- در الکتروشیمی، اسید نیتریک به عنوان یک عامل دوپینگ شیمیایی برای نیمه هادی آلی و در فرآیند های خالص سازی برای نانولوله های کربنی خام استفاده می گردد.
- در غلظت کم، این اسید اغلب در نجاری برای پیری مصنوعی کاج و افرا مورد استفاده قرار می گیرد. رنگ تولید شده خاکستری-طلایی است که بسیار شبیه موم قدیمی یا چوب روغنی است.
- اسید نیتریک می تواند به عنوان یک آزمایش نقطه ای برای آلکالوئیدهایی مانند LSD استفاده شود که بسته به آلکالوئید، رنگ های متنوعی تولید می کند.
- در خالص سازی طلا و نقره نیز کاربرد دارد.
روشهای تولید اسید نیتریک
اسید نیتریک به دلیل استفاده های مختلف به دو صورت جداگانه تولید می گردد. روش آزمایشگاهی و روش تجاری که هر یک از این روش ها بنا به نوع مصرف و حجم تولیدی مراحل گوناگونی دارند. با ما همراه باشید تا به صورت کامل با این مراحل آشنا شویم.
تهیه آزمایشگاهی
اسید نیتریک معمولاً با حرارت دادن نیترات پتاسیم یا نیترات سدیم با اسید سولفوریک غلیظ تهیه می شود. گرمایش در یک مخزن شیشه ای انجام می شود و بخارات آن در گیرنده ای که توسط آب خنک می شود، متراکم می شوند.
NaNO3 + H2SO4 → HNO3 + NaHSO4
تهیه تجاری به روش فرآیند استوالد
در مقیاس تجاری (صنعتی)، اسید نیتریک را می توان با اکسیداسیون کاتالیزوری آمونیاک به دست آورد. این فرآیند تولید، فرآیند استوالد نامیده می شود. در این فرآیند، تبدیل آمونیاک به اسید نیتریک از طریق ۳مرحله زیر انجام می شود:
مرحله۱. اکسیداسیون آمونیاک به اکسید نیتریک: آمونیاک توسط هوا در حضور کاتالیزور پلاتین در دمای ۸۰۰ درجه سانتیگراد اکسید می شود.
4 NH3(g) + 5 O2(g) → 4 NO(g) + 6 H2O(g) (ΔH = −905.2 kJ/mol)
مرحله۲. اکسیداسیون نیتریک اکسید به دی اکسید نیتروژن: اکسید نیتریک توسط هوا در دمای حدود ۱۰۰تا ۱۵۰ درجه سانتیگراد به دی اکسید نیتروژن اکسید می شود.
2 NO(g) + O2(g) → 2 NO2(g) (ΔH = −114 kJ/mol)
مرحله3. تشکیل اسید نیتریک:
دی اکسید نیتروژن متعاقباً در آب جذب می شود و اسید نیتریک و اکسید نیتریک را تشکیل می دهد.
3 NO2(g) + H2O(l) → 2 HNO3(aq) + NO(g) (ΔH = −135.74 kJ/mol)
اکسید نیتریک برای اکسیداسیون مجدد وارد چرخه می شود.
4 NO2(g) + O2(g) + 2 H2O(l) → 4 HNO3(aq)
HNO3 مایع به دست آمده را می توان با تقطیر تا حدود ۶۸ درصد جرمی تغلیظ کرد. غلظت بیشتر تا ۹۸% را می توان با آبگیری با H2SO4 غلیظ به دست آورد. با استفاده از آمونیاک حاصل از فرآیند هابر، محصول نهایی را می توان از نیتروژن، هیدروژن و اکسیژن تولید کرد که از هوا و گاز طبیعی به دست می آیند.
انواع اسید نیتریک دود کننده
با اضافه کردن گاز به اسید صددرصد، اسید نیتریک دود کننده به دست می آید. به دو دسته دود کننده سرخ رنگ و دود کننده سفید رنگ تقسیم میشود و برای ساخت موشک کاربرد دارد.
اسید نیتریک دودکننده قرمز
اسید نیتریک دودکننده قرمز (RFNA)، حاوی مقادیر قابل توجهی دی اکسید نیتروژن محلول است که موجب رنگ قرمز مایل به قهوه ای می شود. همچنین یک اکسید کننده انبار شده است که به عنوان پیشران موشک استفاده می شود.
اسید نیتریک دودکننده سفید
از دو درصد آب و بقیه هم اسید نیتریک تهیه می شود. این نوع اسید، در تهیه نیتروگلیسیرین هم کاربرد دارد.
حمل و نقل اسید نیتریک
هر روز، صنعت حمل و نقل، کانتینر های زیادی را در سراسر جهان جابه جا می کند. بسیاری از این کانتینر ها حاوی کالا ها و مواد خطرناک هستند. به عنوان مثال، اسید نیتریک یک اسید معدنی بسیار خورنده و سمی است که خاصیت اکسید کننده قوی دارد. در عین حال، باید مرتباً نگهداری و ارسال شود زیرا معمولاً همانطور که گفته شد، برای کاربردهای صنعتی و زندگی روزمره بسیار پرکاربرد است. بنابراین، ظروف حمل و نقل مناسب اسید نیتریک بسیار مهم هستند.
از آنجایی که اسید نیتریک به عنوان یک ماده “خطرناک” طبقه بندی می شود، ضروری است که به طور ایمن در انبار برای حمل و نقل نگهداری شود. هنگامی که ظروف نگهداری حاوی ماده ای است، ضروری است که ظرف با مواد سازگار باشد به این معنی که نه مواد و نه ظرف نباید تحت تأثیر تماس مستقیم بین یکد یگر قرار گیرند. فولاد ضد زنگ به دلیل مقاومت بالایی که در برابر خوردگی دارد، معمولاً برای ظروف حمل و نقل اسید نیتریک استفاده می شود. طبق مقررات، اسید نیتریک باید در بشکه فولاد ضد زنگ درجه ۳۰۴ ذخیره شود. این یک فولاد ضد زنگ درجه متوسط است که به طور گسترده به عنوان “فولاد ضد زنگ درجه مواد غذایی” نیز شناخته می شود.
ظروف حمل و نقل اسید نیتریک استیل از هرگونه واکنش بین اسید و ظرف جلوگیری می کند. علاوه بر این، بر خلاف ظروف پلاستیکی، به راحتی هواگیری می شوند و تمایل کمتری به “بالون” شدن در اثر افزایش فشار ناشی از اسید دارند. همچنین به دلیل محتوای کروم فولاد ضد زنگ، برخلاف ظروف ساخته شده از فلزات دیگر، در برابر خوردگی مقاوم هستند.
شرایط نگهداری از اسید نیتریک
- در ظرف مختص به خود نگهداری شود.
- ظرف را به صورت عمودی و محکم بسته و در کابینت نگهداری اسید نگه دارید.
- در سطح چشم یا بالاتر از آن نگهداری نشود.
- ظروف نگهداری باید خشک باشند، زیرا اسید نیتریک می تواند با آب یا بخار واکنش داده و گرما و بخارات سمی، خورنده و قابل اشتعال تولید کند.
- از ظروف ثانویه (سینی یا وان نالژن / پلی پروپیلن) برای جداسازی اسید نیتریک از سایر اسید های موجود در کابینت اسید خود استفاده کنید.
- مقادیر بیشتر از ۵۰۰ میلی لیتر باید در یک کابینت جدا از سایر مواد شیمیایی ذخیره شود.
- توجه داشته باشید که ظروف آلوده ممکن است تحت فشار قرار گیرند و یا منفجر شوند!
- محلول های Aqua Regia را مهر و موم یا نگهداری طولانی مدت نکنید! آنها میتوانند اکسید شوند و گازهای سمی تشکیل دهند و ظروف تحت فشار ممکن است منفجر شوند.
خطرات و موارد احتیاط
اسید نیتریک در صورت استنشاق، بلع یا جذب از طریق پوست ممکن است مضر باشد. برای غشا های مخاطی و بافت های دستگاه تنفسی فوقانی بسیار مخرب است. باعث سوختگی شدید پوست و چشم می شود و ممکن است باعث کوری و آسیب دائمی چشم شود. استنشاق آن ممکن است باعث اسپاسم، التهاب حنجره و برونشیت شود. ممکن است تأثیرات به تعویق بیفتد. دوز های زیاد ممکن است منجر به سیانوز یا کاهش شدید فشار خون، کما و احتمالاً مرگ شود. قرار گرفتن در معرض مزمن ممکن است باعث فرسایش دندان ها، نکروز فک و آسیب کلیه گردد.
- در صورت امکان استفاده و ذخیره سازی اسید نیتریک را به حداقل برسانید یا حذف کنید.
- تمامی اعضای آزمایشگاه و دانشجویان را در مورد شیوه های استفاده از اسید نیتریک آموزش دهید.
- همیشه در داخل یک هود شیمیایی و در نزدیکی ایستگاه های شستشوی چشم و دوش ایمنی از اسید استفاده کنید.
- از تماس با پوست، چشم و لباس خود داری کنید. از دستکش های سازگار، عینک ایمنی و روپوش آزمایشگاهی استفاده کنید.
- ظروف اسید در صورت عدم استفاده باید بسته بماند.
- از تماس اسید نیتریک با فلزات خودداری کنید! این اسید در حضور آلومینیوم، مس و اکسیدها بسیار خورنده است و به تمام فلزات اساسی حمله می کند.
- دور از نور مستقیم خورشید، منابع اشتعال، مواد قابل احتراق و مواد ناسازگار، فلزات قلیایی، بازها، عوامل کاهنده، سیانید ها، آلدهید ها، استون، فلزات پودری، آمونیاک و انیدرید استیک، اسید ها و همه مواد آلی از جمله حلال های آلی نگهداری شود.
- در ظروف شیشه ای ایمن، خشک، خنک و دارای برچسب واضح نگهداری گردد.
- هنگام رقیق کردن، همیشه اسید را به آب اضافه کنید نه برعکس.
- ظروف را به صورت ماهانه از نظر تغییر رنگ بررسی کنید. درخواست جمع آوری زباله های شیمیایی برای هر گونه اسید نیتریک تغییر رنگ داده شده ارسال کنید.
- بیش از حد خرید نکنید؛ فقط حداقل مقدار باید در آزمایشگاه نگهداری شود.
تدابیر ضروری نگهداری اسید نیتریک
مواجهه با پوست
لباس ها و کفش های آلوده را بردارید، به مدت ۱۵دقیقه در دوش ایمنی با صابون بشویید. در اسرع وقت به درمانگاه مراجعه کنید.
قرار گرفتن در معرض چشم
در اسرع وقت به درمانگاه مراجعه کنید، لنز های خود را بردارید و چشم ها را به مدت ۱۵ دقیقه بشویید.
کاربردهای اسید نیتریک
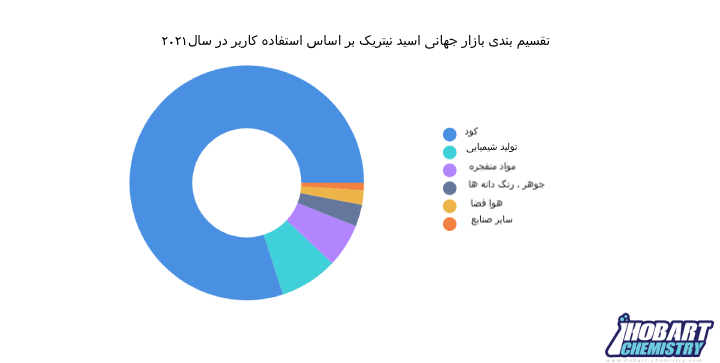
اسید نیتریک یک اسید معدنی بی رنگ و بسیار خورنده است. این اسید می تواند از طریق یک فرآیند دو مرحله ای شامل اکسیداسیون آمونیاک و سپس جذب اکسیدهای نیتروژن تولید شود. اسید اسید خطرناک کاربردهای عمده ای در صنعت کود دارد. بازار آن بر اساس صنعت و جغرافیای مصرف کننده نهایی تقسیم بندی شده است. بر اساس صنعت مصرف کننده نهایی، بازار به کود، هوافضا، جوهر، رنگدانه و رنگ، تولید مواد شیمیایی، مواد منفجره و سایر صنایع مصرف کننده نهایی تقسیم می شود.
تحلیل بازار جهانی
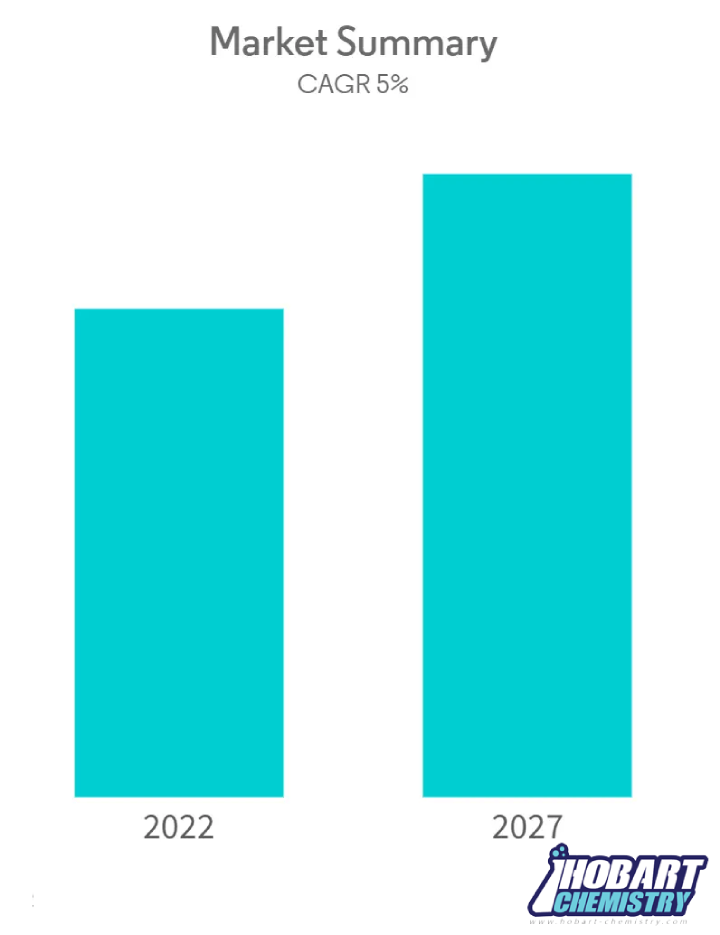
بازار اسید نیتریک در سال ۲۰۲۱ بیش از ۲۴ میلیارد دلار ارزش داشت و پیش بینی می شود که بازار تا سال ۲۰۲۷ بیش از ۵٪ رشد را ثبت کند.
به دلیل شیوع کووید-۱۹، قرنطینه های سراسری در سراسر جهان اتفاق افتاد. این امر اختلال در فعالیت های تولیدی و زنجیره تامین و توقف تولید اسید نیتریک را در پی داشت که تاثیر منفی بر بازار در سال ۲۰۲۰ گذاشت. با این حال، شرایط در سال ۲۰۲۱ شروع به بهبود کرد و در نتیجه مسیر رشد بازار را بازیابی کرد. انتظار می رود در کوتاه مدت، افزایش تقاضا برای اسید نیتریک از صنعت کود، باعث رشد بازار شود. از طرف دیگر، خطرات مربوط به سلامت ناشی از استفاده از آن احتمالاً مانع رشد بازار می شود. کود، از نظر تقاضا، بخش غالب در دوره پیش بینی است. همچنین انتظار می رود که منطقه آسیا و اقیانوسیه با بیشترین مصرف از کشور هایی مانند چین، ژاپن و هند بر بازار در سطح جهانی تسلط داشته باشند.
عوامل اثرگذار بر بازار اسید نیتریک برای کاربرد کود
بیش از ۸۰ درصد از اسید نیتریک در تولید کود استفاده می شود. کودهایی مانند نیترات آمونیوم و نیترات کلسیم آمونیوم از همین اسید تولید می شوند. برای پاسخگویی به تقاضای فزاینده جهانی غذا، زمین های قابل کشت بیشتری مورد نیاز است. از این رو، تقاضای کود در حال افزایش است.
نیترات آمونیوم یک کود مبتنی بر نیتروژن محبوب و کارآمد با حدود ۳۵٪ (بر حسب جرم) محتوای نیتروژن کل است. علاوه بر این، کود نیترات کلسیم آمونیوم(CAN) دارای محتوای نیتروژن ۲۵-۲۸٪ است. کود CAN برای تامین نیتروژن برای پیشبرد رشد هر گیاهی استفاده می شود. نیترات کلسیم آمونیوم با مخلوط کردن نیترات آمونیوم مذاب و کربنات کلسیم در دمای حدود ۱۷۰درجه سانتیگراد تولید می شود. ماهیت آن رطوبت سنجی است و می تواند رطوبت محیط را جذب کند. بنابراین، نیترات کلسیم آمونیوم را می توان در خاک بدون آب کافی استفاده کرد.
بر اساس گزارش سازمان غذا و کشاورزی ایالات متحده (FAO)، انتظار می رود تقاضای جهانی برای کود در سال های ۲۰۲۱ و۲۰۲۲ به ترتیب به ۹۳/۱۹۷ میلیون تن و ۹۲/۲۰۰ میلیون تن برسد و کودهای مبتنی بر نیتروژن رشد ۴/۱ درصدی رابه ثبت برساندند.بنابراین، عوامل ذکر شده در بالا احتمالاً بر بازار اسید نیتریک برای کاربرد کود تا سال ۲۰۲۷ تأثیر می گذارد.
قیمت اسید نیتریک
مجموعه هوبارت شیمی یکی از بزرگترین مجموعههای تولید کننده انواع مواد شیمیایی از جمله اسید بوریک، اسید سولفوریک و… در مقیاس های صنعتی می باشد. این مجموعه به یاری خداوند و تلاش کادر زحمت کش و کمک متخصصین توانمند در سراسر خط تولید توانسته است محصولاتی با بالاترین کیفیت جهت ارائه به بازار مصرف تولید کند. اسید نیتریک از جمله محصولاتی است که به دلیل دارا بودن درصد خلوص، بسته بندی و حجم محصول متفاوت، از تنوع بالایی برخوردار است. همکاران ما در واحد فروش مواد شیمیایی به صورت شبانه روزی اماده ارائه اطلاعات خدمت شما عزیزان هستند به همین جهت برای کسب اطلاعات بیشترمی توانید با واحد فروش ما تماس حاصل فرمایید.













نقد و بررسیها
هیچ دیدگاهی برای این محصول نوشته نشده است.