اسید سولفوریک (H₂So₄) با نامهای مشابه جوهر گوگرد، سولفات هیدروژن و سولفوریک اسید، یکی از مهمترین مواد شیمیایی موجود در جهان محسوب میشود. این اسید بسیار قوی در محلولهای آبی کاملاً یونیزه میشود و یونهای هیدرونیوم (H3O+) و یونهای سولفات هیدروژن (HSO4-) را تشکیل میدهد. در محلولهای رقیق، یونهای سولفات هیدروژن نیز تجزیه میشوند و یونهای هیدرونیوم و یونهای سولفات بیشتری را تشکیل میدهند (SO42-).
اسید سولفوریک (Sulfuric acid) چیست؟
اسیدی بسیار قوی و در زمره مواد شیمیایی بسیار خطرناک قرار میگیرد این ماده بی رنگ، خورنده و واکنش پذیر است و با هر درصدی در آب حل میشود. دارای نقطه ذوب 10 درجه سانتی گراد و نقطه جوش 335 درجه سانتی گراد میباشد. در گذشته با نام جوهر گوگرد خوانده میشد. اسید سولفوریک برای نخستین بار توسط جابربن حیان کشف شد.
اسید سولفوریک غلیظ علاوه بر اینکه یک عامل اکسید کننده است و در دماهای بالا به راحتی با بسیاری از فلزات، کربن، گوگرد و مواد دیگر واکنش نشان میدهد، همچنین یک عامل خشک کننده قوی است که به شدت با آب ترکیب میشود. در خلوص بالا، بسیاری از مواد آلی مانند چوب، کاغذ یا شکر را تبدیل به زغال میکند و پسماند کربنی باقی میگذارد.
اصطلاح اسید سولفوریک بخار یا اولئوم به محلولهای تری اکسید گوگرد در اسید سولفوریک 100 درصد اطلاق میشود. این محلولها که معمولاً حاوی 20، 40 یا 65 درصد تری اکسید گوگرد هستند، برای تهیه مواد شیمیایی آلی استفاده میشوند.
تاریخچه اسید سولفوریک
تاریخچه سولفوریک اسید به دورانی از باستان باز میگردد که سومریها به مطالعه انواع ویتریولها پرداختند. (اسید سولفوریک در میان کیمیاگران قرون وسطی به عنوان ویتریول شناخته میشد ویتریولها در واقع دستهای از مواد معدنی شیشهای هستند که اسید را میتوان از آنها استخراج کرد که با توجه به رنگ بندی شان شناسایی میشوند).
برخی از اولین نشانهها درباره مطالعه خواص ویتریولها در آثار پزشک یونانی دیسکوریدس وطبیعت شناس رومی پلینی بزرگ مشاهده میشود.
جالینوس نیز درباره کاربردهای پزشکی ویتریولها صحبت کرده و همچنین کاربردهای متالورژیکی برای این مواد شیشهای در آثار کیمیاگری هلنیستی نیز آمده که قدیمیترین کتاب کیمیاگری نیز مطلق به اوست.
اما قدیمیترین مدارک موجود که احتمالا به تهیه اسید سولفوریک منجر گشته به قرن هشتم میلادی بر میگردد که در آن جابر ابن حیان با تقطیر کانیهای سولفات آهن (آهن سولفات هفت آبه و مس (||) سولفاته این اسید را تولید کرد.)
اما اسید سولفوریک برای اولین بار در قرن نهم توسط دانشمند ایرانی زکریای رازی کشف شد. او این اسید را از طریق تقطیر خشک کانیهایی که شامل سولفات آهن معروف به (زاج سبز) و سولفات مس معروف به (کات کبود) بدست آورد.
اسید سولفوریک در حدود قرون سیزدهم روغن ویتریول نیز نامیده میشد که از طریق برشته کردن ویتریول سبز که همان (سولفات آهن (||) میباشد در دستگاهی به اسم توتگاه آهنی تهیه میگشته و اولین اشارهها به این موضوع در آثار وینسنت بووه دیده میشود.
در قرن هفدهم، یوهان گلابر شیمیدان آلمانی-هلندی اسید سولفوریک را با سوزاندن گوگرد همراه با نمک (نیترات پتاسیمKNO3) در حضور بخار آب تولید کرد. پس از آن در سال 1736 جاشوا وارد، داروساز لندنی از این روش برای شروع اولین تولید این ماده شیمیایی مهم در مقیاس بزرگ استفاده کرد.
در سال ۱۷۴۶ در بیرمنگام، جان روباک (John Roebuck) این روش را برای تولید اسید سولفوریک در محفظههای سرب که قوی تر و ارزان تر بودند و حجم بیشتری نسبت به ظروف شیشهای قبلی داشتند اقتباس کرد.
این فرآیند امکان صنعتی سازی موثر تولید اسید سولفوریک را فراهم کرد. این روش پس از آن حدود دو قرن به عنوان روش استاندارد تولید باقی ماند.
سولفوریک اسید تولید شده توسط جان روباک به غلظت ۶۵٪ بسیار نزدیک بود. به همین دلیل اصلاحات بعدی جهت رسیدن به غلظت بیشتر توسط شیمی دان فرانسوی لوئیس گیلوساک و شیمی دان انگلیسی گلوور باعث افزایش غلظت اسید در حدود ۷۸٪ شد.
با این حال برای تولید بسیاری از محصولات به غلظت بالاتری از این ماده نیاز بود. سر انجام در سال۱۸۳۱ پرگرین فیلیپس تاجر بریتانیایی سرکه روش تماسی را برای تولید اسید سولفوریک به ثبت رساند که روشی بسیار مقرون به صرفه برای تولید این ماده غلیظ بود و امروزه تمامی تولیدات جهان تقریبا با این روش انجام میشود.
خطرات استفاده از اسید سولفوریک
این ماده نیز مانند سود پرک مادهای سمی و در صورت استنشاق یا بلعیده شدن میتواند سبب مرگ شود. در صورت تماس با پوست سبب زخم و سوختگی عمیق و در صورت تماس با چشم سبب کوری در فرد میشود.
اسید سولفوریک باید به شکل درست و صحیحی مورد استفاده قرار بگیرد، زیرا بسیار خورنده است و باعث سوختگی شدید و جدی میشود. این ماده علاوه بر پوست، میتواند فلزات، سنگ و کاغذ را از بین ببرد و به اصطلاح بخورد. هنگام استفاده از اسید سولفوریک در محیطهای آزمایشگاهی و صنعتی، باید حتما از تجهیزات مناسب مانند ماسک، محافظ صورت، دستکش بلند لاستیکی، عینک ایمنی و چکمه استفاده کنید. قرار گرفتن طولانی مدت و مداوم در معرض این ماده شیمیایی باعث تحریک شدید چشم، تحریک دستگاه تنفسی، آسیب به بافتها و فرسایش دندانها میشود.
- تماس اسید سولفوریک با پوست و چشم و بلع و استنشاق آن، بسیار خطرناک است و آسیبهای جدی به بدن و سلامتی وارد میکند. در صورت بروز هر یک از این اتفاقها، خیلی سریع به پزشک مراجعه کنید تا آسیبهای وارده و خطرات احتمالی دیگر را به حداقل برسانید.
- تماس این ماده شیمیایی با چشم میتواند باعث کوری دائمیشود. در صورت بروز این اتفاق، بلافاصله چشم خود را با آب، به مدت حداقل ۳۰ دقیقه بشویید و سریع به پزشک مراجعه کنید.
- تماس این اسید با پوست باعث زخم شدن و خوردگی آن میشود. اگر اسید سولفوریک با پوست شما تماس پیدا کرد، بلافاصله ناحیه آسیب دیده را با آب ولرم، به مدت 30 دقیقه بی وقفه شست و شو دهید و به پزشک مراجعه نمایید.
- بلع این ماده شیمیایی میتواند باعث حالت تهوع، استفراغ و سوختگی جوارح داخلی شود و به عضوهای داخلی آسیب غیر قابل جبران وارد کند. در صورت بروز این اتفاق، بلافاصله دهان خود را با آب سرد بشویید و سریعا به پزشک متخصص مراجعه کنید.
- اگر این اسید را استنشاق کنید، بینی و حلق شما ملتهب و تحریک میشود و باید سریعا در معرض هوای تازه قرار بگیرید و به پزشک مراجعه کنید.
ویژگی و خصوصیات جوهر گوگرد
این ماده شامل مولکولهای دارای گشتاور قطبی است که میتوانند با یکدیگر پیوند هیدروژنی برقرار کنند. این ماده شیمیایی مایعی است با نقطه جوش بالا و هم چنین یک مایع ویسکوز (دارای گران روی زیاد) محسوب میشود.
همین شرایط مولکولی باعث میشوند که این ماده به خوبی در آب حل شود و محلولهای اسیدی مختلف تولید کند.
اسید سولفوریک مایعی غلیظ میباشد که دارای بوی تندی است، نقطه جوش آن بسیار بالا بوده و علاوه بر این که از ترکیب مادههای دیگر میتوان آن را ساخت به صورت ارگانیک در طبیعت نیز یافت میشود. یعنی از گازهای منتشر شده آتشفشانها بدست میآید و میتوان آن را جمع آوری کرد. اما با توجه به اینکه تمایل زیادی به جذب بخار آب دارد به طور طبیعی و خالص در روی زمین وجود ندارد. اسید سولفوریک با توجه به خلوصش دارای رنگهای متفاوتی نیز میباشد (بی رنگ تا قهوه ای) یعنی هر چه خلوص آن زیاد باشد رنگ کم رنگ تری دارد.
این ماده با توجه به انحلال پذیری بالایی که دارد شدت گرمازایی آن بسیار زیاد است. اسید سولفوریک در بارانهای اسیدی بخش عمدهای را تشکیل میدهد و این ماده میتواند به صورت آلاینده نیز در هوا معلق بماند و همراه با آب باران فرو ریزد. در هنگام برخورد با فلزات سریعا واکنش نشان میدهد و دمای بالا باعث سرعت و شدت واکنش میشود، ضمنا ناگفته نماند این ماده بر روی فلزاتی چون جیوه و سرب هیچ واکنش و اثری ندارد.
انواع روش تولید اسید سولفوریک
این اسید پرکاربرد با روشهای مختلف و متنوعی تولید میشود؛ روشهایی همچون فرآیند محفظه سرب، فرآیند اسید سولفوریک مرطوب، فرآیند مجاورت و…
رایج ترین و متداول ترین روش تولید این ماده شیمیایی استفاده از گوگرد و بازیافت آن میباشد. اسید سولفوریک در روش استفاده از گوگرد، طی 4 مرحله تولید میشود که در زیر به شرح این مراحل پرداخته ایم.
روش فرآیند مجاورت
مرحله 1: استخراج گوگرد
در مرحله اول، گوگرد که از اصلی ترین و مهم ترین مواد شیمیایی و ترکیبات میباشد، از طریق حرارت دادن سنگ معدن سولفید آهن به دست میآید و تولید میشود.
مرحله 2: تبدیل گوگرد به دی اکسید گوگرد
در این مرحله، گوگرد در مجاورت اکسیژن قرار میگیرد و اکسید میشود. سپس گوگرد مذاب و اکسید شده در یک کوره پاشیده میشود و از طریق انفجار هوای خشک سوزانده میگردد. سوختن گوگرد با شعله آبی مشخص میشود و گاز تولید شده طی هر فرآیند، شامل تقریبا 12 درصد دی اکسید گوگرد و 10 درصد اکسیژن میباشد.
مرحله 3: تبدیل دی اکسید گوگرد به تری اکسید گوگرد
دی اکسید گوگرد در مجاورت کاتالیزگر قرار میگیرد و با اکسیژن اضافی واکنش میدهد. در نهایت به تری اکسید گوگرد تبدیل میشود.
مرحله 4: تبدیل تری اکسید گوگرد به اسید سولفوریک
از واکنش تری اکسید گوگرد با آب، اسید سولفوریک به دست میآید. البته از واکنش دی اکسید گوگرد با هیدروژن پر اکسید یا آب اکسیژنه، نیز این ماده شیمیایی تولید میشود.
تولید اسید سولفوریک به روش مرطوب
روش تولید اسید سولفوریک به روش مرطوب اولین بار توسط یک شرکت دانمارکی در سال 1980 ایجاد شد .این شیوه یک روش بسیار مناسب و کارآمد میباشد که از بازیافت گوگرد از گازهای صنعتی بدست میآید که باید با فشار بخار بالایی اقدام به تولید آن کرد.
در همه صنایعی که در از بین بردن گوگرد در آنها به مشکل بر میخوریم از روش مرطوب استفاده میشود.
مراحل روش مرطوب:
در مرحله اول، با سوزاندن گوگرد آن را تبدیل به گوگرد دی اکسید میکنیم.
S + O → SO2
و یا هیدروژن سولفید با اکسیژن میسوزانیم و گاز گوگرد دی اکسید تولید میشود.
2 H2S + 3 O2 → 2 H2O + 2 SO2
سپس گوگرد دی اکسید با کمک کاتالیزور وانادیم اکسید با اکسیژن سوزانده میشود و به گوگرد تری اکسید تبدیل میشود. این واکنش تعادلی و برگشت پذیر است.
2 SO2 + O2 → 2 SO3
در نهایت گوگرد تری اکسید هیدراته شده و به سولفوریک اسید گازی تبدیل میشود.در مرحله آخر اسید گازی متراکم شده و به مایعی با غلظت 07-98 درصد تبدیل میشود.
SO3 + H2O → H2SO4
تولید اسید سولفوریک به روش محفظه سرب
در این روش گوگرد با خلوص بالا را با حرارت غیر مستقیم به وسیله کویل بخار تبدیل به مایع میکنیم. گوگرد در دمای ۱۵۰ درجه سانتی گراد به حالت مایع در میآید. در صورت مایع بودن گوگرد به راحتی میتوان آن را با پمپ مخصوص به کوره فرستاد. مقدار جرم گوگرد مذاب در داخل کوره احتراق باید با کنترل مسیر برگشتی به درون حوضچه یا تنظیم سوزن مشعل کوره، تنظیم شود.
طبق فرمول زیر، گوگرد با احتراق در دمای ۱۰۰۰-۹۵۰ درجه سانتی گراد به گوگرد دیاکسید تبدیل میشود.
۲PbS(s) + 3O2 → ۲PbO(s) + 2SO2
S + O2 → SO2 + q
اکسیژن را به وسیله دمنده تا 150 درجه سانتی گراد گرم میکنیم تا از پایین آمدن دمای کوره جلوگیری کنیم، سپس تبدیل SO2 به SO3 انجام میپذیرد.
کاتالیزگر در این برج وانادیم پنتااکسید به صورت چهار لایه قرار دارد، بصورتی که دو لایه به هم متصل بوده و ما بین آنها تنها یک صفحه فلزی مشبک وجود دارد. مقدار کاتالیزگر در این چهار لایه متفاوت است. یعنی در لایه چهارم که پایینترین لایه است بیشترین مقدار در حدود 70درصد کاتالیزگر وجود دارد. بقیه لایهها به ترتیب 20 ،7 ،3 درصد کاتالیز در بردارند.
گاز SO2 تولید شده دمای بالایی دارد و با وجود این حرارت اگر وارد کاتالیزگر شود آن را از بین میبرد. به همین دلیل پیش از ورود به برج دمای آن را باید کاهش دهیم که برای این کار باید آن را وارد دیگ تولید بخار کنیم تا دمایش را در حدود 500 درج سانتی گراد کاهش دهد.با توجه به این که احتمال وجود ذرههای گرد و غبار وسیلیس و عنصرهایی همچون سرب و آرسنیک (ناخالصیهای احتمالی گوگرد) وجود دارد که باید گاز را از صافی سیلیسی ویژه بگذرانیم.
در این صافی علاوه براین که گاز را از ناخالصیها نجات میدهیم با تزریق هوای خشک و خنک به گاز، کمبود اکسیژن نیز برطرف میکنیم، دما به حدود ۴۵۰ درجه سانتی گراد میرسد که دمایی مناسب برای ورود به برج کاتالیزگر است.
SO2 +1/2 O2 → SO3 + q
گاز SO3 تولید شده، هنوز مقداری SO2 به همراه دارد و برای تبدیل SO2به SO3باید آن را از لایههای سوم و چهارم کاتالیزگر نیز عبور دهیم تا باقی مانده SO2 نیز به SO3 تبدیل شود.
گاز بیرون آمده از لایه چهارم وارد یک مبدل گرمایی دیگری میشود که این کار باعث خنک شدن آن تا حدود 240 درجه سانتیگراد میگردد، آنگاه وارد برج اولئوم و در آخر وارد برج اسید میشود.
گاز SO3 و اسید در این برجها خلاف جهت یکدیگر حرکت میکنند به صورتی که اسید به صورت از بالای برج به پایین سرازیر میشود و گاز از پایین، روانهی بالای برج میشود. این کار باعث جذب گاز SO3 به اسید شده، اولئوم یا اسید سولفوریک دودکننده ایجاد میکند،و یعنی همان اسید سولفوریک است.
SO3 +H2O →H2SO4 + q
H2SO4 + SO3→ H2S2O7
تولید اسید سولفوریک به روش آزمایشگاهی سنتز
تولید اسید سولفوریک با استفاده از روش آزمایشگاهی به صورت زیر انجام میگیرد.
وقتی گاز گوگرد دی اکسید با هیدروژن پراکسید(آب اکسیژنه) واکنش مییابد:
SO2 + H2O2 → H2SO4
سپس با استفاده از الکترولیز محلول مس (ll) سولفات که در این فرآیند، کاتد باید یک فلز با رسانایی خوب و آند از جنس پلاتین یا زغال (به منظور عدم واکنش با محلول) باشد.
تولید اسید سولفید به روش الکتروبرومین
روش الکتروبرومین پرهزینهترین، خطرناکترین و دردسر سازترین روش میباشد که از مخلوطی از گوگرد، آب و اسید هیدروبرومیک است که به عنوان محلول الکترولیتی از آن استفاده میکنند.
در این روش گوگرد به پایین ظرف زیر محلول اسید فشار داده میشود سپس کاتد مس و آند پلاتین،گرافیت با کاتد در نزدیکی سطح ظرف قرار میگیرد و آند در پایین الکترولیت قرار گرفته تا جریان را اعمال کند. این کار ممکن است نیاز به زمان بیشتری داشته باشد و باعث ساطع شدن بخارهای سمی برم و سولفور برومید شود. اما اسید واکنش دهنده را میتوان بازیافت کرد، یعنی به طور کلی با حذف تلفات اسید، گوگرد و آب به اسید سولفوریک و هیدروژن تبدیل میشوند.
- الکترولیز هیدروژن برمید آبی:
2 HBr → H 2 + Br 2
- تولید اولیه تری بروماید، در نهایت با کاهش Br- معکوس میشود:
Br 2 + Br − ↔ Br-
- برم با گوگرد واکنش داده و دی سولفور دی برومید تشکیل میدهد:
2 S + Br 2 → S 2 Br 2
- اکسیداسیون و هیدراتاسیون دی سولفور دی برومید:
S 2 Br 2 + 8 H 2 O + 5 Br 2 → 2 H 2 SO 4 + 12 HBr
انواع اسید سولفوریک بر اساس درصد خلوص
اسید سولفوریک در دسته مواد شیمیایی قرار گرفته که جزو مواد بسیار خطر ناک محسوب میگردندد. این اسید پرکاربرد برای مصارف مختلف در سه خلوص ۹۸٪، ۵۰٪، ۳۵٪ تولید میشود.
اسید سلفوریک ۹۸٪ یعنی از هر صد گرم محلول موجود ۹۸درصد آن از اسید تشکیل شده و فقط دو درصد ناخالصی دارد این خلوص از اسید توانایی تجزیه بافتهای زنده و حتی سنگ را نیز دارا است. به همین دلیل باید هنگام استفاده از آن تمهیدات امنیتی به شدت رعایت شود.
اسید سولفوریک ۹۸٪ به شدت خوردنده میباشد و بخشی از بارانهای اسیدی را نیز شامل میشود که بر اثر برخورد قطرات باران با الودگیهای موجود سبب تولید اسید سلفوریک نیز میگرددند. ناگفته نماند اسیدی با این درصد خلوص به دلیل غلظت بالا از پایداری بیشتری نیز برخوردار است و به همین دلیل اکثر اسید خالص نیز تلقی میگردد.
رقیق کردن اسید سولفوریک
اسید سولفوریک عمدتا غلیظ است و از غلظت بالایی برخوردار میباشد. در برخی از صنایع و مشاغل، به نمونه رقیق نیاز میباشد و باید اسید غلیظ را رقیق کرد. برای رقیق کردن این ماده شیمیایی به هیچ وجه نباید به آن آب اضافه کرد، زیرا این ماده شیمیایی خیلی سریع با آب واکنش میدهد و جوشیده و پاشیده میشود. برای رقیق کردن این اسید، باید ابتدا آب را داخل یک ظرف ریخت و سپس کم کم و به آهستگی اسید را به آب اضافه کرد تا اسید جوشش و پاشش نکند.
کاربردهای سولفوریک اسید
در ادامه مهمترین کاربردهای این ماده شیمیایی را برایتان بیان خواهیم نمود. با هوبارت شیمی همراه باشید…
کاربرد اسید سولفوریک در کشاورزی
کاربرد اسید سولفوریک در کشاورزی در تهیه کود شیمیایی فسفاته میباشد. با توجه به اینکه کودهای شیمیایی ۶٠ درصد بازار مصرف این اسید را به خود اختصاص دادهاند میتوان گفت بیشترین استفاده از اسید سولفوریک در زمینه تهیه و تولید کودهای شیمیایی است. تولید کود سولفات آمونیم، کود سوپر فسفات نرمال و همچنین استفاده مستقیم از این ماده با مخلوط کردن آن با کودهای مایع انجام میپذیرد.
کاربرد در صنایع معدنی و فلزی
اسید سولفوریک با ترکیب قوی که دارد برای زدودن هرگونه ناخالصیهای کربنی و یا زدودن زنگ زدگی در فرآوری فلزات مختلف از جمله آهن، مس و فولاد مورد استفاده قرار میگیرد.
کاربرد اسید سولفوریک در صنایع شیمیایی
این ماده شیمیایی یک جزء ضروری در تولید اسیدهای یخ، حشره کشها، داروها و… میباشد که مورد استفاده قرار میگیرد. همچنین در احیای آلومینیوم بسیار کاربردی میباشد. لازم به ذکر است که از این اسید در تهیه اسید هیدروکلریک و اسید نیتریک نیز استفاده میشود.
کاربرد در شویندهها
اسید سولفوریک به دلیل خاصیت چربی گیری قوی که دارد در تهیه و تولید انواع مواد شوینده و لوله بازکنها، شست و شوی کاشیها و… مورد استفاده قرار میگیرد. به عنوان مثال صابون، از یک زنجیر هیدروکربن متصل به نمک یک اسید محلول در آب تشکیل شده است. باید توجه داشت که طول زنجیر و نوع هیدروکربن مورد استفاده بطور مناسب انتخاب گردد.
تولید باتری و آب باتری اتومبیل
باتریها در اتومبیلها و همچنین تراکتورها بمنظور استارت اولیه ماشین آلات مکانیکی استفاده میشود. در تولید این باتریها، اسید سولفوریک به عنوان الکترولیت مورد استفاده قرار میگیرد. اگر چه مقدار و غلظت اسید مورد نیاز برای هر باطری میتواند متفاوت باشد.
ساخت مهمات و مواد منفجره
نیتروگلیسیرین مادهای سمی با قدرت تخریب بالایی میباشد که در تولید آن از اسید سولفوریک استفاده میکنند؛ همچنین از این ماده شیمیایی پرکاربرد در تولید مواد منفجره مانند TNT،RDX و PETN نیز استفاده میشود.
کاربرد در پالایش نفت
با توجه به اینکه نفت ترکیبی به شدت آلوده کننده زیست محیطی است، باید حتما مورد پالایش قرار گرفته سپس به مصرف برسد یکی از موادی که در پالایش نفت بسیار کاربرد دارد اسید سولفوریک میباشد. به پالایش نفت با این مدل اسید، پالایش شیمیایی نیز گفته میشود.
کاربرد اسید سولفوریک در صنایع رنگ
اسید سولفوریک یکی از موادی است که در تهیه رنگ مورد استفاده قرار میگیرد اما امروزه به دلیل خاصیت خورندگی بالا، خیلی کمتر از آن استفاده میشود و همچنین رنگهای تهیه شدهای که در ترکیبات آن اسید سولفوریک به کار رفته است در نهایت کدر شده و به زردی میگراید.
کاربردها در نساجی
اسید سولفوریک در صنعت ریسندگی و همچنین ساخت ابریشم مصنوعی کاربرد دارد. از این ماده برای تثبیت رنگ پارچه و نخ و خنثی سازی رنگ و همچنین در قسمتهای آماده سازی و ریسندگی و رنگ آمیزی پشم از آن به وفور استفاده میشود.
با توجه به اینکه ابریشم طبیعی مادهای بسیار گرانقیمت است و استفاده آن در تمام لباسها ممکن نمیباشد، تصمیم به ساخت ابریشم مصنوعی گرفتهاند که تقریبا خاصیت ابریشم طبیعی را دارا میباشد. در تهیه و تولید این ابریشم مصنوعی از اسید سولفوریک استفاده میشود. این ماده با مخلوط ماده الیاف سلولزی و تترا آمین مس ترکیب شده و منجر به ساخت ابریشم مصنوعی میگردد.
کاربرد در صنعت کاغذ
اسید سولفوریک یک زاج سفید و منعقد کننده بسیار قوی میباشد که در صنعت کاغذسازی با تاثیر بر ویژگیهای آنیونی مورد استفاده قرار میگیرد. این ماده در پروسه تولید کاغذ یکی از مهم ترین مواد میباشد.
آنادایزینگ آلومینیوم
آنادایزینگ آلومینیوم سبب سختی سطح، مقاومت به سایش، مقاومت به خوردگی و چسبندگی عالی اکسید میگردد که این ویژگیها باعث افزایش قابل ملاحظه کاربرد آلومینیوم در صنعت شده است. آنودایز آلومینیوم با تشکیل یک لایهی نازک اکسیدی بر روی قطعات آلومینیومی، علاوه برافزایش مقاومت در برابر خوردگی،به ایجاد نمای تزئینی قطعات نیز میشود و همچنین موجب تغییر برخی از خصوصیات فیزیکی آنها میگردد.
آندایزینگ معمولا با محلولهای اسید سولفوریک و دیگر اسیدها با مقادیر مختلف و پتانسیلهای کاربردی و تراکم به انجام میرسد. از این روش برای مقاوم سازی انواع مخزنهای اسید استفاده میشود. اگر به دنبال خرید مخزن برای نگهداری و ذخیره اسید هستید بر روی عبارت مخزن اسید کلیک کنید.
بسته بندی و حمل و نقل اسید سولفوریک
همانطور که گفته شد، اسید سولفوریک بسیار خورنده، سنگین و قوی است و به همین دلیل باید تحت شرایط خاصی، بسته بندی و حمل شود. این محصول عمدتا در مخازن 1000 لیتری، بشکههای 220 لیتری، گالنهای 20 لیتری، گالنهای 2.5 لیتری و به صورت فله بسته بندی میشود و به فروش میرسد. ریختن آب بر روی این ماده شیمیایی، چه رقیق باشد و چه غلیظ، بسیار خطرناک است و باعث پاشیده شدن آن به اطراف و حتی منفجر شدن آن میشود. اگر قصد ترکیب اسید سولفوریک با آب را داشتید، ابتدا آب را در ظرفی مانند بشر یا ارلن بریزید و بعد اسید را قطره قطره به آن اضافه کنید.
برای ذخیره و حمل و نقل این ماده معمولا از مخازن پلاستیکی یا پلی اتیلنی دو لایه استفاده میشود و این کار تحت شرایط خاصی انجام میگیرد. بستها و اتصالات این مخازن پلاستیکی یا پلی اتیلنی دو لایه، عموما از جنس پلی اتیلن یا پلی وینیل کلراید میباشند.
بازار جهانی اسید سولفوریک
اسید سولفوریک در دسته اسیدهای معدنی قرار دارد که جزء قوی ترین اسیدها همچون اسید سیتریک و اسید نیتریک نیز به شمار میرود. از گذشته تاکنون با توجه به تقاضای زیاد، مصرف این اسید روند صعودی داشته به طوری که جزء مواد اولیه بسیاری از صنایع مهم نیز به شمار میرود.
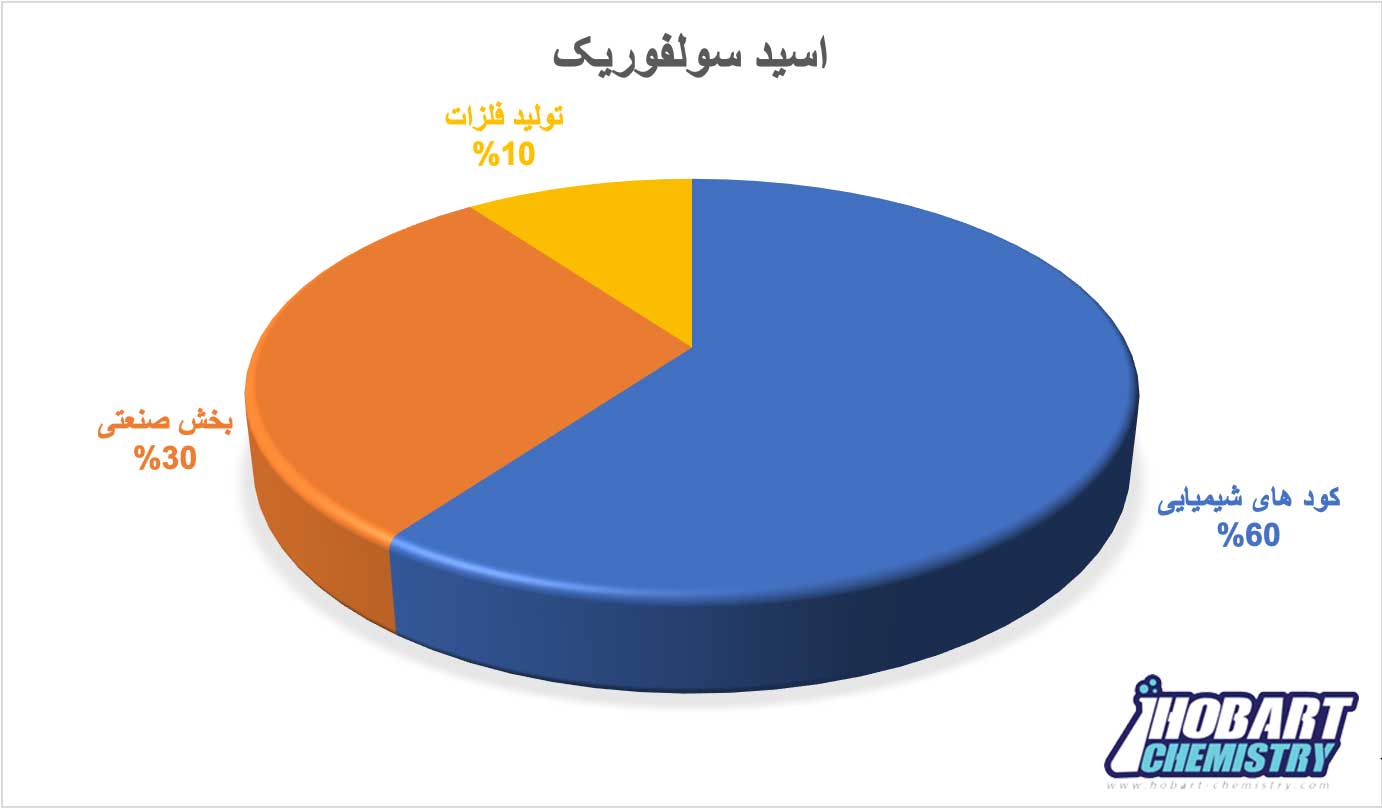
تولید جهانی اسید سولفوریک در سال 2017 بیش از 275 میلیون تن برآورد شده که از این حجم تولید حدود ۶۰ درصد از کل تقاضای جهانی به کودهای شیمیایی اختصاص دارد و حدود 30% به بخش صنعتی و 10% به تولید فلزاتی چون مس، نیکل، اورانیوم و… اختصاص دارد.
از میان کل اسید سولفوریک تولیدی در جهان تنها 7% آن به صورت صادرات و واردات مبادله میشود. دلیل اصلی این درصد کم از مبادله، چیزی جز خورنده بودن این ماده شیمیایی و همچنین هزینه احداث بنادر حمل و نقل مختص آن نیست.
قیمت اسید سولفوریک
قیمت اسید سولفوریک با توجه به عواملی همچون غلظت، میزان خلوص، حجم، نوع کاربرد، نحوه ارائه، نوع بسته بندی، میزان پایداری، شرکت تولید کننده، بازار مصرف و عرضه و تقاضا تعیین میشود. شرایط سخت نگهداری و حمل و نقل باعث میشود که قیمت آن کمی بالاتر از دیگر اسیدها باشد. قیمت جهانی گوگرد و قیمت جهانی سوخت، بر روی قیمت نهایی این ماده شیمیایی نیز تاثیرگذار میباشد.











صیادی –
خیلی هم عالی
من 50 لیتر تهیه کردم ، کی بدستم میرسه؟
ممنون از وب سایت خوبتون
dms-admin –
با سلام
برای سفارش های ارسالی با آقای مهندس عادلی در ارتباط باشید. با تشکر
علیپور –
ممنون از شما . واقعا همونی بود که می خواستم،کامل و بدون نقص